世の中の物は元素でできている。それを一覧で見ることができるのが周期表だ。周期表の見方をここで整理する。
周期表とは?
周期表は、性質や特徴を考慮して元素を並べた表であり、原子番号順に元素が並んでいる。
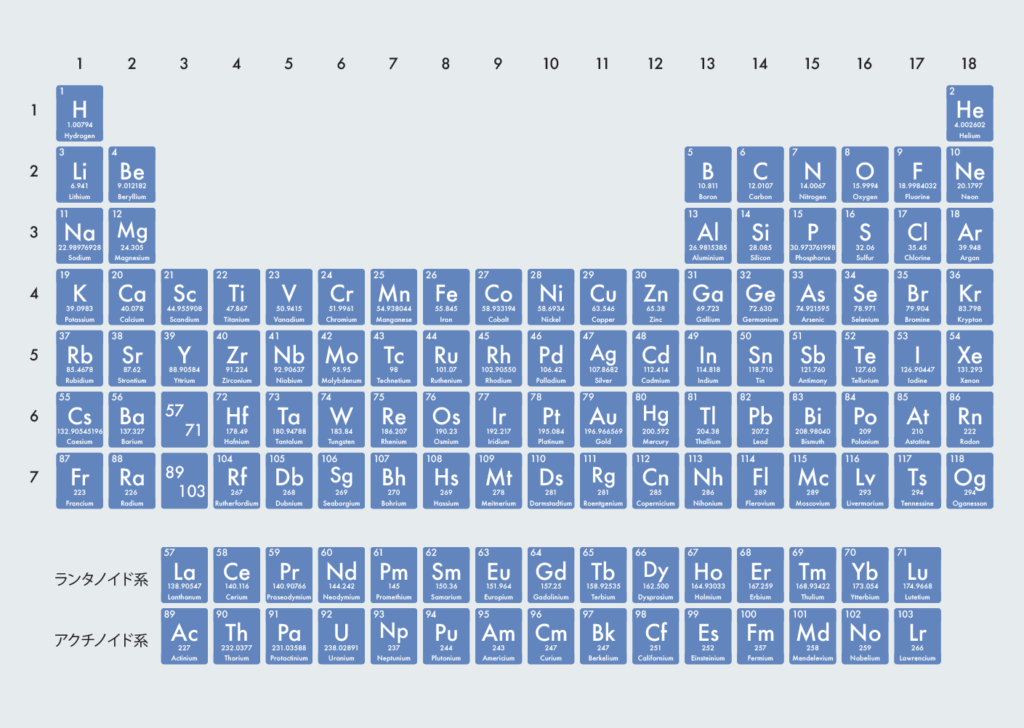
周期表の見方
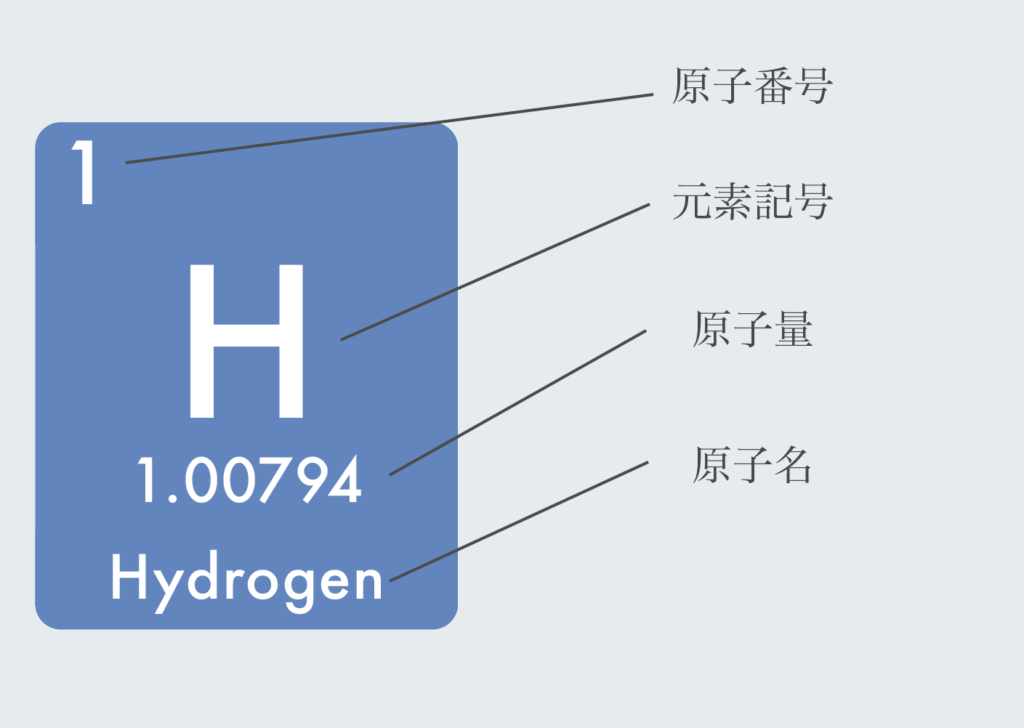
周期表は以下のような表記がされている。
- 原子番号 (原子核内の陽子の数)
- 元素記号 ( H, He, Li, Beなど)
- 原子量(一定の基準によって定めた原子の質量)
- 原子名(水素、ヘリウム、リチウムなど)
原子番号とは?
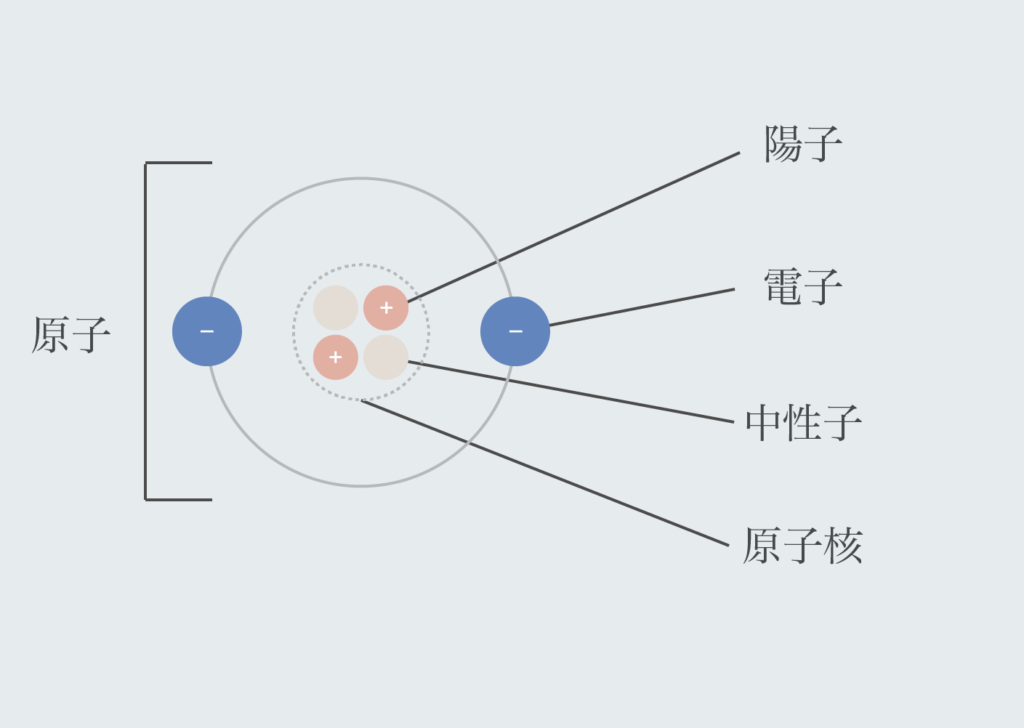
原子番号は原子核内の陽子の数で表す。原子内はどうなっているかというと、陽子、電子、中性子、原子核で構成される。
- 原子核:原子核は陽子と中性子からできているもの。電子はいつも原子核の周りを回っている。
- 電子:電子とは負の電荷(電気の元)を持つ素粒子(物質の元となる粒)で、いつも原子核の周りを回っている。
- 陽子:原子核の中にある素粒子で、正の電荷を持つ。
- 中性子:原子核の中にある素粒子で、電荷を持たない。
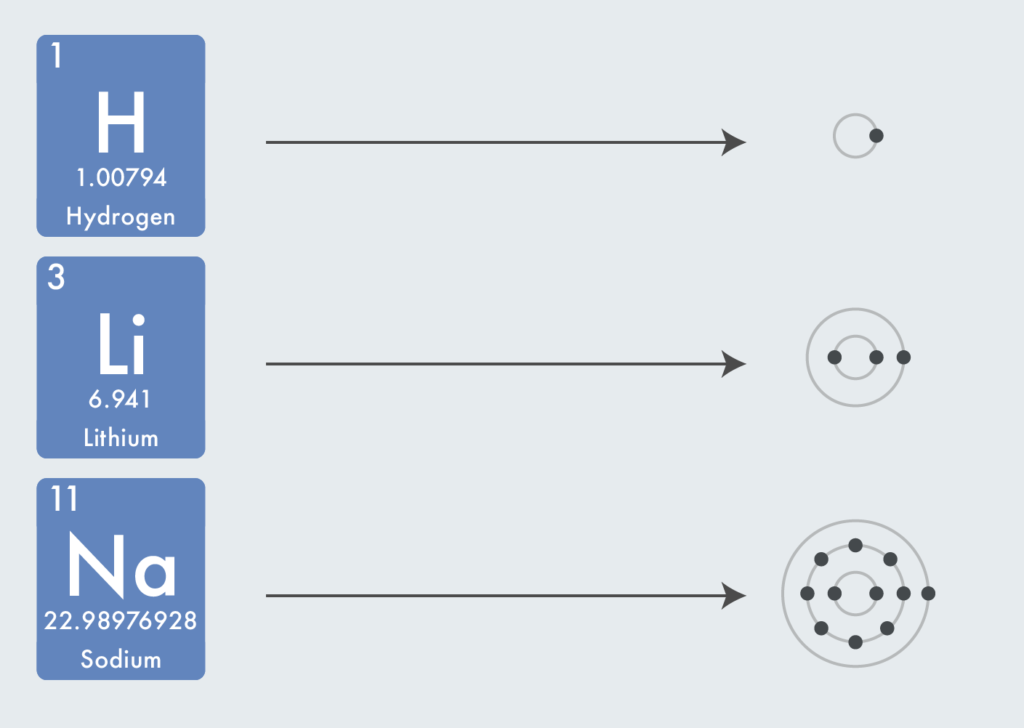
どんな原子でも陽子と電子の数は同じなので、原子番号は陽子の数であると共に、電子の数とも同じになる。
元素と原子の違い
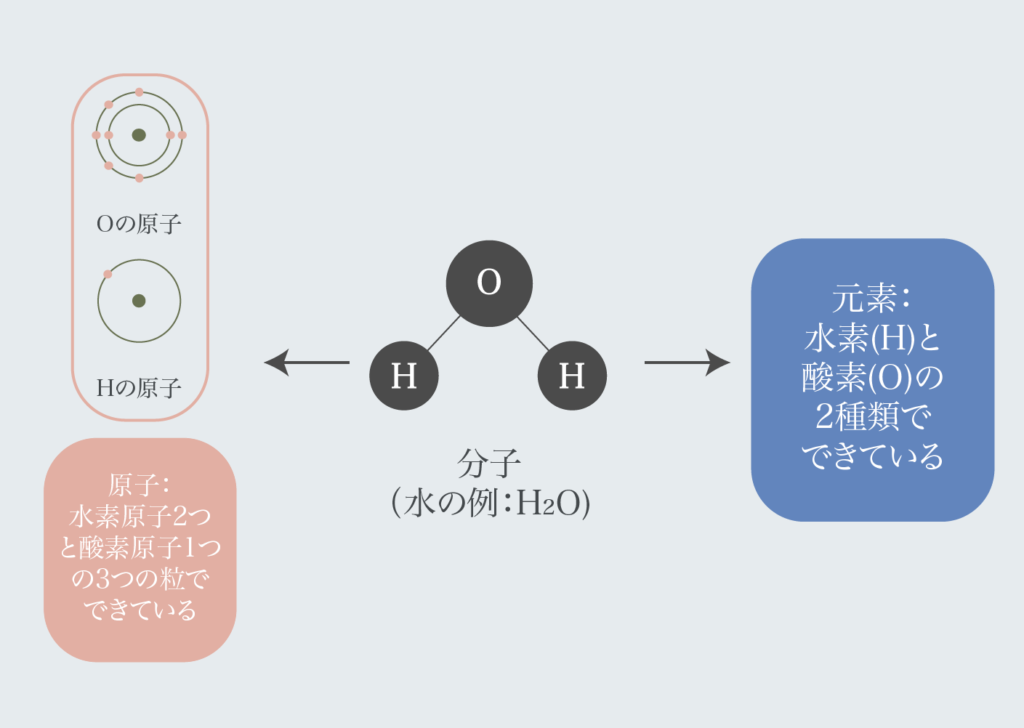
「原子」は物質を構成する粒のことを指し、「元素」は原子の種類のことを指す。
例えば水H2Oで例えると:
- 元素:H2Oは水素(H)と酸素(O)の2種類でできている
- 原子:水素原子2つと酸素原子1つの形3つでできている
ということができる。
周期表の族と周期
周期表の縦の列を「族」といい、横の行を「周期」という。

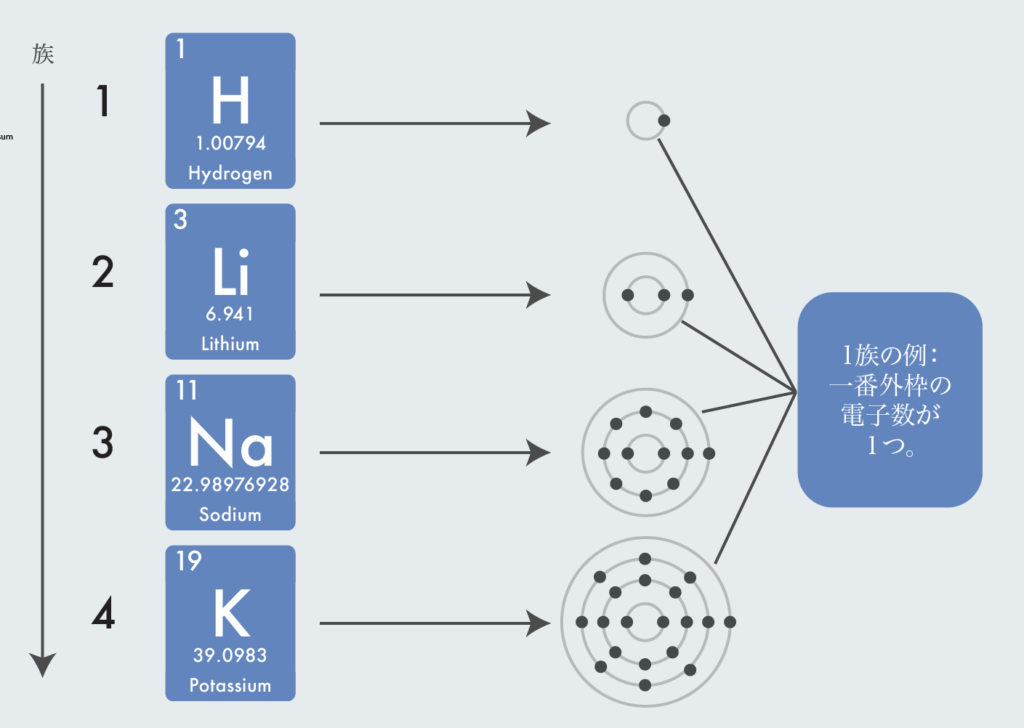
同じ族だと価電子数が同じで化学的性質が似るようになる。例えば1族の例で考えると、一番外枠の殻の電子数は1つで共通している。
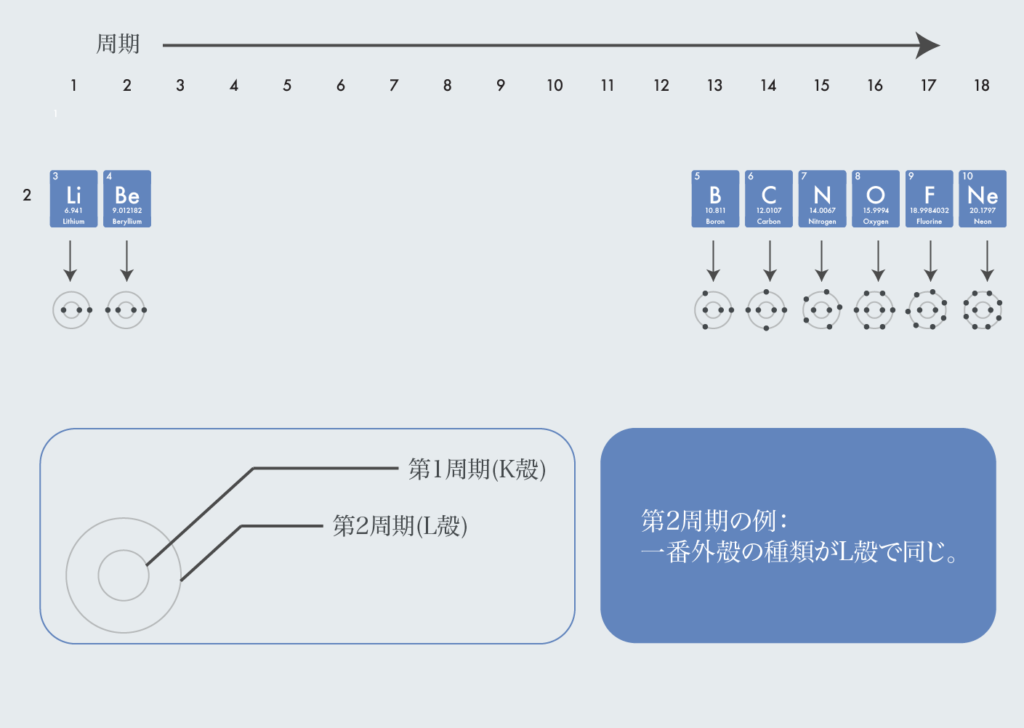
また、同じ周期だと最外殻の種類が同じになる。第2周期の例だと、K殻とL殻の2つの殻で原子が構成されている。
周期表で分類できる元素の性質
元素の性質としては、以下のように分けることができる。
- 金属元素と非金属元素
- 典型元素と遷移元素
- アルカリ金属・アルカリ土類金属・ハロゲン・希ガス
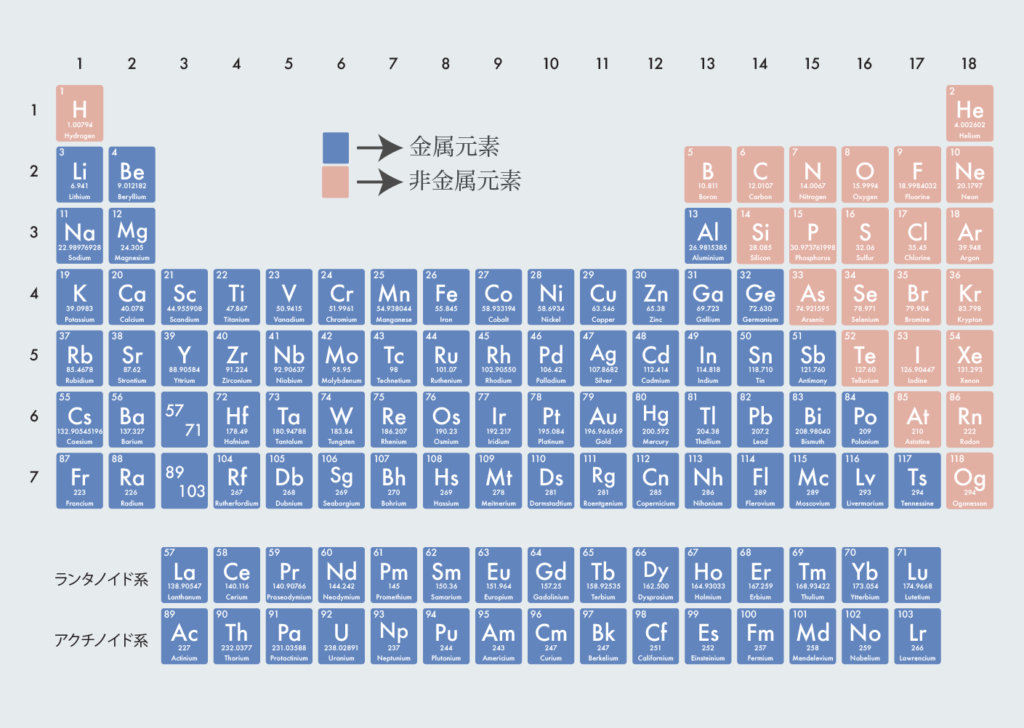
金属元素と非金属元素
周期表では、金属元素と非金属元素に分けることができる。
金属元素の特徴は以下の通り:
- 金属光沢(光を通さず不透明であり、光を反射させる。)
- 電気伝導性(電気が流れる)
- 熱伝導性(熱が伝わる)
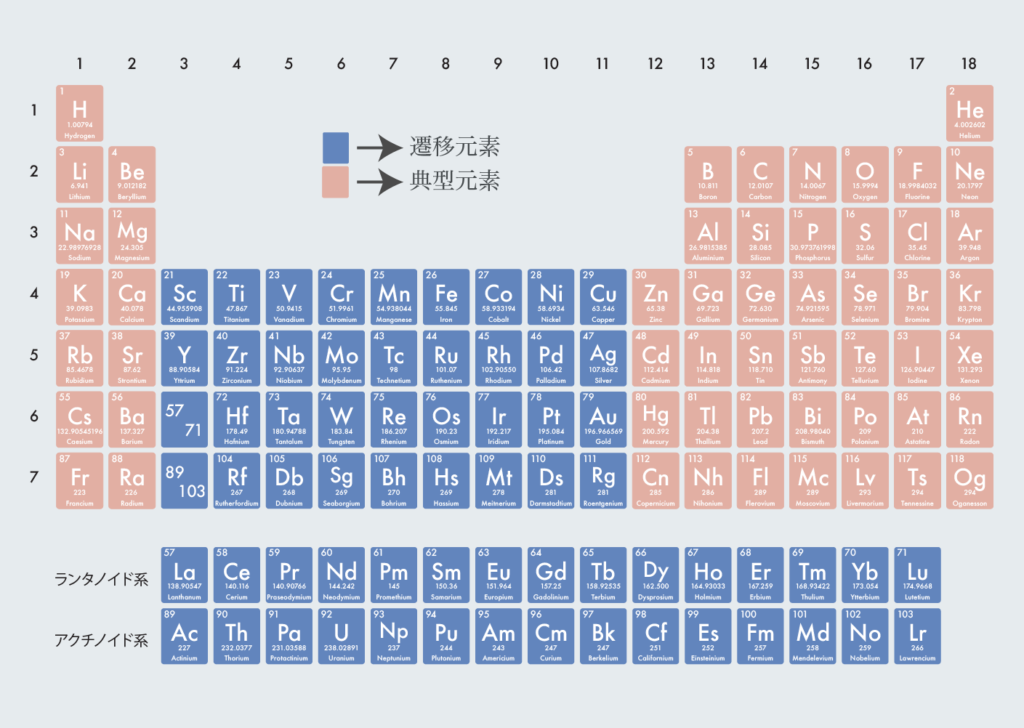
典型元素と遷移元素
典型元素と遷移元素の分類は以下の通り。
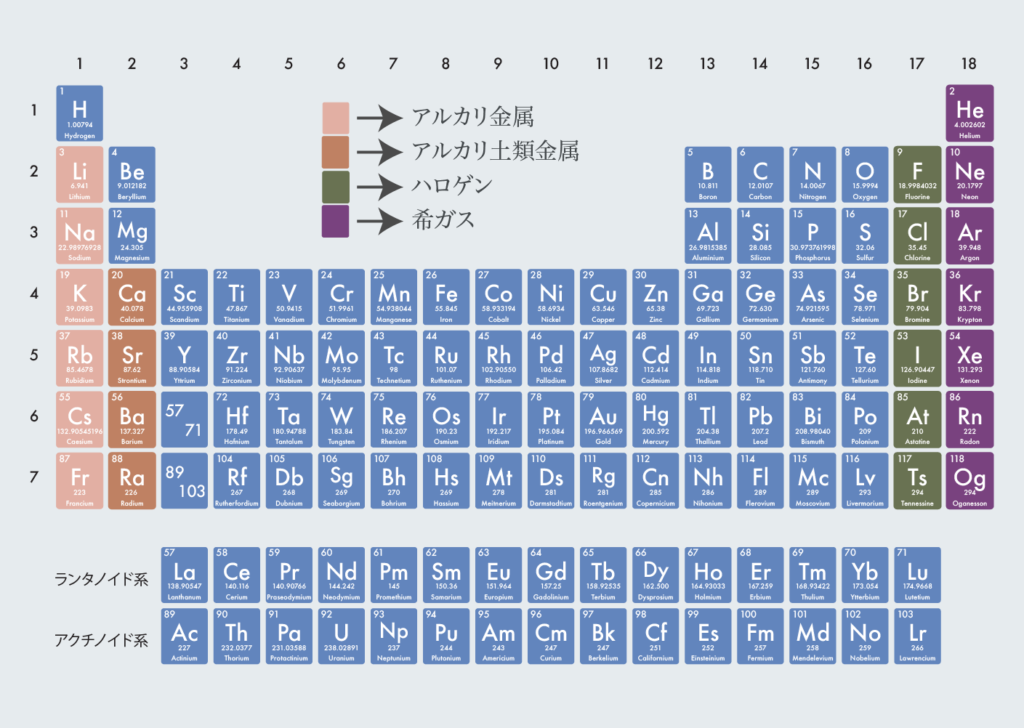
アルカリ金属・アルカリ土類金属・ハロゲン・希ガス
アルカリ金属・アルカリ土類金属・ハロゲン・希ガスの分類は以下の通り。